Nieuwe indicaties voor diabetesmiddelen
Bij diabetes wordt al lange tijd de zogenaamde SGLT-2 remmers voorgeschreven. Er zijn nieuwe inzichten in de (positieve) effecten van deze geneesmiddelen op het voorkomen van hartfalen. Mogelijk zullen deze middelen daardoor breder worden ingezet en kan het gebruik hierdoor bij patiënten met diabetes stijgen van ruim 15.000 naar meer dan 100.000 gebruikers op een relatief korte termijn.
Uit deze studies kwamen ook positieve effecten naar voren bij patiënten met hartfalen en nierfalen zonder diabetes. De verwachting is dan ook dat deze geneesmiddelen, naast bredere inzet bij patiënten met diabetes, hun indicatiegebied zullen uitbreiden naar patiënten zonder diabetes. In de Horizonscan is op dit moment alleen dapagliflozine opgenomen voor deze indicaties maar de verwachting is dat andere SGLT-2 remmers zoals canagliflozine en empegliflozine zullen volgen. Het totale gebruik van SGLT2-remmers zal om deze reden flink toe gaan nemen. De verwachting is dan ook dat het gebruik van SGLT2-remmers bij patiënten met hartfalen zonder diabetes mellitus mogelijk zal uitbreiden naar 250.000 -500.000 patiënten.
Aantal geneesmiddelen en indicatie-uitbreidingen in de Horizonscan groeit gestaag
Dit betreft de zesde publicatie van de Horizonscan sinds deze belegd is bij het Zorginstituut. In figuur 1 is te zien dat het aantal nieuwe geneesmiddelen en indicatieuitbreidingen per publicatie gestaag is toegenomen. Deze toename is te verklaren door de progressie die is geboekt op het gebied van het scannen, de intensievere samenwerking tussen de verschillende zorgpartijen en de toenemende mate van
bijdragen vanuit de farmaceutische industrie.
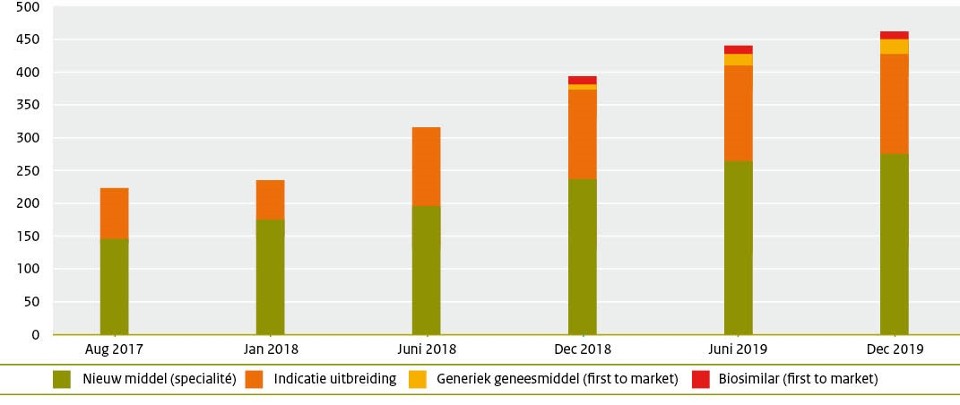
Figuur 1. Toename van het aantal type indicaties van geneesmiddelen
In de Horizonscan staan alle nieuw te verwachten spécialités en indicatieuitbreidingen die de komende 2 jaar op de markt komen. Verder worden sinds december 2018 ook de biosimilars en generieken opgenomen die als eerste op er markt verwacht worden om te concurreren met het spécialité. Ongeveer 60% van de producten betreffen spécialités en ongeveer een derde zijn indicatieuitbreidingen van reeds bestaande geneesmiddelen. Het lage percentage generieken en biosimilars komt met name omdat in de Horizonscan alleen ‘first-to-market’ producten opgenomen worden. Tweede en volgende generieken en biosimilars worden niet meer weergegeven. In figuur 1 is ook weergegeven wat de verdeling van de verschillende producten is in de Horizonscan. In vergelijking met de vorige publicaties zijn de verhoudingen vergelijkbaar.
Van klinische studie tot vergoeding
De geneesmiddelen in de Horizonscan bevinden zich in verschillende fasen van registratie of ontwikkeling. Geneesmiddelen verschijnen op de Horizonscan ongeveer vanaf fase 3 van de klinische studies en worden gevolgd tot ze zijn geregistreerd en een betaaltitel hebben in Nederland. Figuur 2 geeft een globaal overzicht van deze stadia. In totaal zijn er ruim 465 producten opgenomen waarvan er 420 mogelijk de komende twee jaar kunnen worden toegelaten tot het basispakket. In sommige gevallen valt een geneesmiddel uit door tegenvallende studieresultaten waardoor ze ofwel door de fabrikant worden teruggetrokken of door de beoordelingscommissie (CHMP; Commission of Human Medical Products) van de EMA (European Medicines Agency) een negatieve opinie krijgen. Ongeveer 100 producten worden mogelijk het komende jaar geregistreerd.
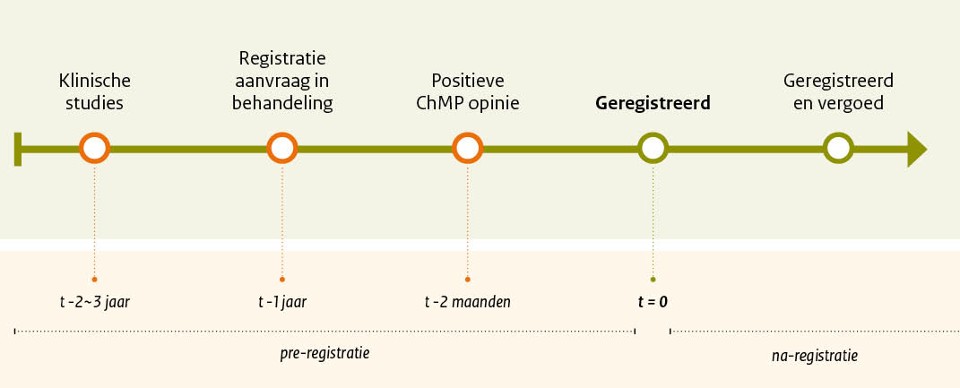 Figuur 2. Overzicht van de verschillende stadia van geneesmiddelen inde Horizonscan
Figuur 2. Overzicht van de verschillende stadia van geneesmiddelen inde Horizonscan
In 2018 zijn er bij de EMA evenveel nieuwe geneesmiddelen goedgekeurd als indicatieuitbreidingen. In de Horizonscan beslaat het aantal indicatieuitbreidingen ongeveer een derde. Redenen voor dit verschil zijn dat er meer nieuwe geneesmiddelen zijn opgenomen die in eerdere fasen van het ontwikkelingstraject stranden en dat het ontwikkelings- en registratietraject van indicatieuitbreidingen sneller is en ze dus pas korter van tevoren in beeld komen.
Tabel 1 geeft een overzicht van het aantal producten op de Horizonscan die in één van deze fases zitten. Ook hier zit zijn de aantallen van de afgelopen 2 publicaties vergelijkbaar.
 Tabel 1. Overzicht van stadia van geneesmiddelen en indicatie-uitbreidingen
Tabel 1. Overzicht van stadia van geneesmiddelen en indicatie-uitbreidingen
Vooral veel nieuwe geneesmiddelen op gebied van oncologie en neurologie
Van ongeveer 100 producten loopt er een registratieaanvraag en komen mogelijk voor medio 2021 op de markt. Als wordt ingezoomd op de 228 producten geneesmiddelen die nu nog in klinische studies worden onderzocht (zowel indicatieuitbreidingen als spécialités) dan valt op dat de er met name binnen de oncologie en neurologie veel ontwikkelingen in de pijplijn zitten (zie figuur 3).

Figuur 3. Aantal geneesmiddelen in indicatie-uitbreidingen in klinische studies per domein